Janssen søger om godkendelse til psoriasismiddel i ny indikation

Godt to år efter, at Janssen landede den første amerikanske godkendelse til antistofbehandingen Tremfya (guselkumab) søger selskabet nu om at kunne udbrede anvendelsen til endnu en gruppe patienter.
Mandag har selskabet således søgt de amerikanske myndigheder om tilladelse til at markedsføre lægemidlet som en behandling til voksne med aktiv psoriasisgigt.
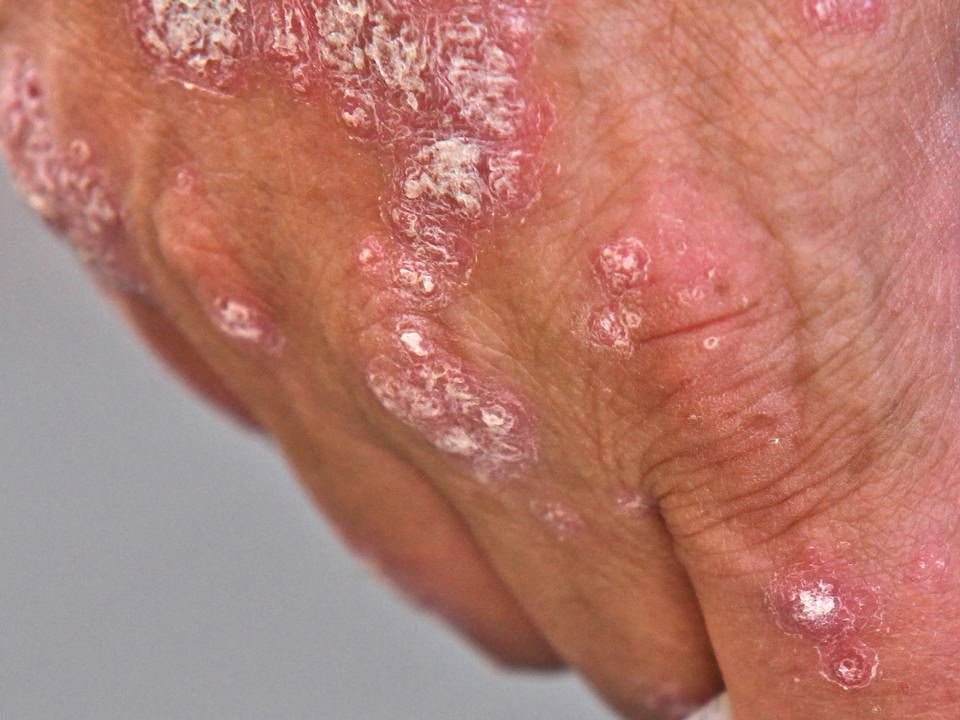
Tremfya har siden 2017 været godkendt i USA til behandling af plaque psoriasis hos voksne, og midlet omsatte i 2018 for 544 mio. dollars – en præstation, som selskabet altså håber at kunne forbedre ved at tilbyde behandlingen til nye grupper af patienter i første i USA og senere også EU, hvor Janssen inden årets udgang ligeledes forventer at søge om tilladelse til at sælge Tremfya mod aktiv psoriasisgigt.
Midlet er en biologisk antistofbehandling, der virker ved at forhindrer signalproteinet interleukin (IL)-23 i at aktivere patientens immunforsvar og begrænse den inflammatoriske reaktion i huden, der spiller en central rolle i udviklingen af psoriasis.
Med en udvidet godkendelse håber Janssen at stå stærkere på markedet for psoriasisbehandling, hvor konkurrencen de senere år spidset gevaldigt til. Blandt de dominerende selskaber er Novartis, Janssen og Eli Lilly, mens også Leo Pharma har gjort sin entre på det biologiske psoriasismarked med Kyntheum.
Tremfya er i Danmark det aktuelle førstevalg til behandling af plaque psoriasis hos voksne, som er kandidater til 2. generations immunmodulerende behandling.
Janssen er medicinaldivisionen under life science-konglomeratet Johnson & Johnson.
Novartis og Janssen ryger i totterne på hinanden over psoriasis-markedsføring Trods massiv konkurrence: J&J ser store muligheder i psoriasis Janssen slår Novartis i nyt psoriasisstudie