FDA godkender endnu en konkurrent til multiblockbuster fra Roche

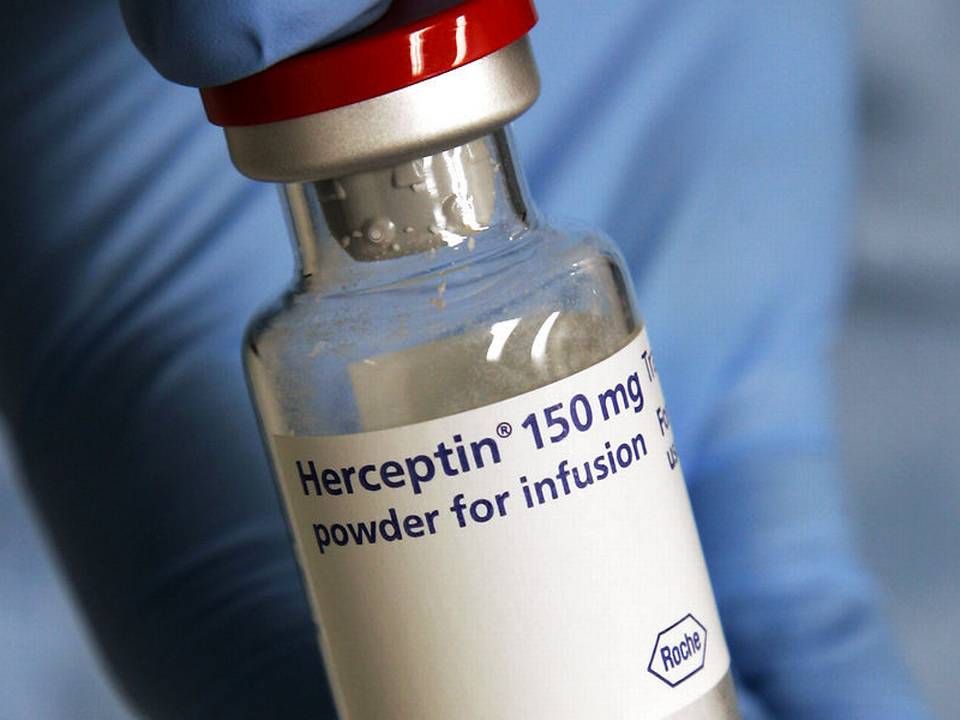
Konkurrencen til Roches multiblockbuster Herceptin (trastuzumab) vokser på det amerikanske marked, hvor lægemiddelmyndighederne, FDA, har godkendt endnu et biosimilært produkt.
Bag lægemidlet står Amgen og Allergan, der med godkendelsen kan markedsføre midlet, der har fået navnet Kanjinti, mod samtlige i forvejen godkendte anvendelsesområdet for Herception, der er godkendt til behandling af brystkræft og visse cancertyper i mave-tarm-regionen.
Kanjinti er den femte godkendte biosimilære konkurrent til Herceptin på det amerikanske marked.
Biosimilært betyder, at midlet er så tæt på en kopi som muligt. Fordi Herceptin er et biologisk lægemiddel baseret på levende organismer, kan det ikke kopieres fuldstændigt, men midlets virkningsmekanisme og kliniske effekt kan efterlignes. Oftest sælges biosimilære lægemidler langt billigere end originalproduktet.
Herceptin solgte i 2018 for knap 7 mia. schweizerfranc, svarende til 46,6 mia. danske kroner.
Udviklingen af Kanjinti er sket i samarbejde mellem Amgen og Allergan, der aktuelt har 10 biosimilære lægemidler i den fælles pipeline. Foruden Kanjinti har de to selskaber tre godkendte biosimilære lægemidler på markedet i EU og USA.
Sandoz indgår partnerskab om efterligning af blockbustermiddel fra Roche Pfizer får godkendt efterligning af Roche-middel i USA FDA godkender ny efterligning af multi-blockbuster fra Roche Roche sagsøger tre tidligere ansatte for at smugle forretningshemmeligheder til Taiwan
Kræftblockbuster fra Roche får biosimilær konkurrence i Danmark Roche får endnu en biosimilær konkurrent til multiblockbuster